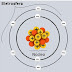
Estrutura do átomo e a tabela periodica
Introdução
No presente trabalho abordaremos sobres
os átomos que são partículas infinitamente pequenas que constituem toda matéria
no universo. Um modelo é uma
representação da realidade (não a própria realidade), assim, os modelos atómicos
são representações dos principais componentes do átomo e de sua estrutura e
explicam determinados comportamentos físicos e químicos da matéria. Isso é
feito porque ainda não é possível ao ser humano enxergar um átomo isolado nem
mesmo com ultramicroscópios.
Estrutura do atomo e a tabela periodica
Entre os modelos atômicos, o mais usado atualmente no
Ensino Médio para o entendimento da estrutura do átomo e suas propriedades é o
de Rutherford-Bohr. Segundo esse modelo, a estrutura do átomo é constituída de
duas partes principais: o núcleo e a eletrosfera.
Duas
partes principais da estrutura de um átomo – eletrosfera e núcleo
* Núcleo: Constituindo-se como a parte
central do átomo, ele é compacto, maciço e muito denso, além de ser formado
pelas partículas de maior massa, que são os prótons e os nêutrons.
Ilustração de prótons e nêutrons que compõem o núcleo atômico
- Prótons: são partículas de carga
elétrica positiva (carga relativa = +1; carga em coulomb (C) = +1,602 . 10-19)
e a sua massa relativa é igual a 1.
- Nêutrons: são partículas de massa
igual à dos prótons (1), mas como o próprio nome indica, eles são neutros, ou
seja, não possuem carga elétrica.
* Eletrosfera: É uma região onde os elétrons ficam
girando ao redor do núcleo. Apesar de ser uma região de volume muito
maior que o do núcleo, ela é praticamente vazia, pois cada elétron é 1836 vezes
menor que 1 próton (ou que 1 nêutron). É por isso que a massa do átomo
concentra-se praticamente toda no núcleo. Os elétrons são partículas de carga
elétrica negativa (-1).
Os
elétrons giram ao redor do núcleo bilhões de vezes por milionésimo de segundo,
dando forma ao átomo e fazendo-o comportar-se como se fosse sólido.

Ilustração de eletrosfera com três camadas eletrônicas e elétrons girando ao redor do núcleo
Resumidamente,
podemos fazer uma tabela para diferenciar as três partículas subatômicas
principais que fazem parte da estrutura do átomo:

Massa e carga elétrica das três partículas subatômicas principais – prótons, nêutrons e elétrons
Os
átomos de todos os elementos químicos são compostos por essas três partículas
subatômicas. O que difere um elemento químico de outro é a quantidade em que
essas partículas aparecem, principalmente a quantidade de prótons no núcleo,
que é chamada de número atômico.
Tabela períodica
Os
elementos são colocados em faixas horizontais (períodos) e faixas verticais
(grupos ou famílias).
Em um
grupo, os elementos têm propriedades semelhantes e, em um período, as
propriedades são diferentes.
Na
tabela há sete períodos.
Os
grupos são numerados de 0 a 8. Com exceção dos grupos 0 e 8, cada grupo está
subdividido em dois subgrupos, A e B. O grupo 8 é chamado de 8B e é constituído
por três faixas verticais.
Modernamente,
cada coluna é chamada de grupo. Há, portanto, 18 grupos numerados de 1 a 18.
Posição dos Elementos na
Tabela Periódica
- Elementos representativos ou típicos (o último elétron é colocado em subnível
s ou p): grupos A. Estão nos extremos da tabela.
- Elementos de transição (o
último elétron é colocado em subnível d; apresentam subnível d
incompleto): grupos 1B, 2B, 3B, 4B, 5B, 6B, 7B e 8B. Estão localizados no
centro da tabela periódica.
- Elementos
de transição interna (o último
elétron é colocado em subnível f; apresentam subnível f incompleto). Estão
divididos em duas classes:
- Lantanídeos (metais terras raras): grupo 3B e 6º período. Elementos de Z =
57 a 71.
- Actinídeos: grupo 3B e 7º período. Elementos de Z = 89
a 103.
- Gases
nobres: grupo zero ou 8A ou
18.
Os
grupos mais conhecidos são:
- 1A: metais alcalinos
- 2A: metais alcalino-terrosos
- 6A: calcogênios
- 7A: halogênios
Relação entre configuração
eletrônica e a posição do elemento na tabela
Período:
Um elemento
com x camadas eletrônicas está no período x.
Exemplo:
P (Z = 15) K = 2 ; L = 8 ; M = 5
P (fósforo) está no 3º período.
Grupo:
a)
Elementos representativos (grupos A) e 1B e 2B. O número de elétrons na camada de valência é o número do grupo.
Exemplo:
P (Z =15) → K = 2 ; L = 8 ; M = 5
O
fósforo está no grupo 5A.
b)
Elementos de transição: a soma do número de elétrons dos subníveis s e d mais
externos é o número do grupo. Exemplo: V (Z = 23)
1s2
2s2 2p6 3s2 3p6 4s2 3d3
Soma s
+ d = 2 + 3 = 5 → grupo 5B.
As fórmulas químicas
As fórmulas químicas foram criadas para
facilitar a representação da composição das substâncias. Por meio delas podemos
discernir a quantidade e os tipos de átomos que formam a substância.
Existem
vários tipos de fórmulas químicas, que variam inclusive conforme o tipo de
ligação. Mas aqui trataremos das principais fórmulas químicas usadas para
representar os compostos moleculares, que são aqueles formados unicamente por ligações covalentes. Quando átomos de dois elementos ligam-se
por meio desse tipo de ligação, eles realizam um compartilhamento de pares de
elétrons. Assim, a primeira fórmula que é usada para representar as ligações
covalentes é uma que mostra os elementos, o número
deles e também os pares de elétrons compartilhados. Essa
é a fórmula eletrônica ou fórmula de Lewis.
Na
fórmula eletrônica, os elétrons da última camada eletrônica (camada de
valência) de cada átomo são mostrados por meio de “pontinhos” ou “x” ao redor
do símbolo do elemento. Por exemplo, o hidrogênio é da família 1, então ele
possui um elétron em sua camada de valência. Já o oxigênio é da família 16 ou
VI-A, logo possui seis elétrons na sua camada de valência:
Elétrons na camada de valência do hidrogênio e oxigênio
Então,
segundo a regra do octeto, o hidrogênio precisa de mais um elétron para ficar
estável (como ele só possui uma camada eletrônica, esse elemento fica estável
com apenas dois elétrons). Já o oxigênio precisa de mais dois para ficar com
oito elétrons e, assim, ficar estável. Logo, dois átomos de H ligam-se a um
átomo de O, realizando dois compartilhamentos de elétrons, isto é, duas
ligações covalentes:

Fórmula
de Lewis da água
Observe
que na fórmula de Lewis os pares de elétrons compartilhados são representados
por uma espécie de “laço” em volta deles, que mostra essa formação das
ligações. Quando ocorre como no caso acima, que entre dois átomos existe apenas
uma ligação, então temos uma ligação simples. Se houver entre dois átomos duas
ligações, será uma ligação dupla, e se forem três ligações, então será uma
ligação tripla. Observe isso abaixo:

Exemplos de ligações covalentes simples, duplas e triplas
Agora vejamos outro tipo de fórmula química
mais simples que a fórmula eletrônica: a fórmula estrutural plana. Essa
fórmula também mostra os elementos e o número de átomos envolvidos, mas a
diferença é que o
par de elétrons compartilhado é simbolizado por um traço (—).
Veja:

Traços usados na fórmula estrutural
Veja
alguns exemplos:

Exemplos de fórmulas estruturais planas
Uma
fórmula química bastante simples de se escrever é a fórmula molecular.
Essa fórmula indica o número real de átomos de cada tipo de elemento
químico que aparece na molécula.
Veja
como fica a fórmula molecular para os compostos mencionados nos exemplos
anteriores:

Noção Do NÚMERO DE OXIDAÇÃO (NOX)
O número de oxidação de
compostos iônicos é a sua própria carga, já no caso dos moleculares é uma carga
teórica que o elemento adquire ao romper sua ligação covalente.
Para os compostos iônicos, o
Número de Oxidação (Nox) representa a própria carga que o íon adquire ao
realizar a ligação iônica. Por
exemplo, o cloreto de sódio é um composto iônico, formado quando o sódio perde
um elétron para o cloro; assim, o sódio se torna um cátion com carga elétrica
de +1, e o cloro um ânion com carga -1. Esses valores constituem seus
respectivos Nox.
No
entanto, os compostos moleculares não perdem nem recebem elétrons, portanto, o
seu Nox é considerado como a carga elétrica teórica que o
elemento adquiriria se a ligação covalente fosse rompida e o par de elétrons
ficasse com o elemento mais eletronegativo. Por exemplo, no caso do
ácido clorídrico (HCl), o cloro é o elemento mais eletronegativo, assim ele
atrairia mais fortemente para si o par de elétrons compartilhado com o
hidrogênio. Desse modo, teremos que o Nox do cloro será -1 (porque ele ficou
com um elétron a mais que era do hidrogênio) e o do hidrogênio é igual a +1
(porque o hidrogênio perdeu um elétron para o cloro).
No caso dos íons simples, o Nox equivale à
sua própria carga elétrica. Por exemplo:
O2-:
Nox = -2
Cl-: Nox = -1
Na+: Nox = +1
Fe2+: Nox = +2
Al3+: Nox = +3
Cl-: Nox = -1
Na+: Nox = +1
Fe2+: Nox = +2
Al3+: Nox = +3
Por
fim, no caso de um elemento ou de
substâncias simples, que são aquelas compostas de átomos de apenas um tipo de
elemento, temos que o Nox é igual a zero. Alguns exemplos e
substâncias assim são: O2, N2, H2, He, etc.
Além disso, o Nox indica a tendência que o
elemento tem de se oxidar ou reduzir, pois quando ocorre a oxidação (perda de
elétrons), o Nox aumenta. Já no caso da redução (ganho de elétrons), ocorre o
contrário, o Nox diminui. Para visualizar esse caso, observe a reação de
oxirredução de formação do gás carbônico abaixo:
0
0
+4-2
Cn(s) + n O2(g) → n CO2(g)
Cn(s) + n O2(g) → n CO2(g)
Observe
que por serem um elemento (C) e uma substância simples (O2), os Nox
dos reagentes eram iguais a zero. Porém, depois da reação, o carbono sofreu
oxidação, assim, observe como seu Nox aumentou (de 0 para +4). Já o oxigênio
sofreu redução, portanto, seu Nox diminuiu, indo de 0 para -2.
Iões positivos e Iões Negativos. Compostos
iónicos
Os iões estão
na origem das substâncias iónicas. Estes corpúsculos são portadores de cargas eléctricas. Os fenómenos
eléctricos explicam-se admitindo a existência de cargas eléctricas.
Por exemplo, pode verificar-se que alguns materiais, em determinadas condições,
adquirem novos comportamentos que se explicam a partir do fenómeno da electrização dos
materiais. Por exemplo, na atmosfera, as nuvens podem
armazenar grandes quantidades de cargas eléctricase
estas manifestarem-se durante uma trovoada com a formação de relâmpagos.
Estes fenómenos
eléctricos manifestam-se
evidenciando forças de naturezarepulsiva e
forças de natureza atractiva: repulsões e atrações elétricas.
Dois materiais
electrizados que
se atraem apresentam carga
eléctrica de natureza oposta: cargas
de sinal contrário.
Dois materiais
electrizados que
se repelem apresentam carga
eléctrica da
mesma natureza: cargas
do mesmo sinal.
Escritas
das Fórmula Química
Uma fórmula química é a representação de uma substância através de
símbolos. Mais importante, ela denota o número de átomos de cada elemento
presente no composto. Por exemplo, a fórmula do Óxido Férrico ou Óxido de Ferro
III é Fe2O3, o qual nos diz que 2 átomos de Fe e 3 átomos
de O estão presentes em uma molécula eletricamente neutra do composto. Para
escrever uma fórmula química formula, deve-se saber os símbolos e valências dos
elementos / radicais.
Escreva
a fórmula química do Fosfato de Cálcio.
Valência do Cálcio (Ca) = 2 ; Valência do Phosphate (PO4) = 3.
Intercambiando suas valências e subscrevendo-as,
A fórmula do Fosfato de Cálcio é Ca3(PO4)2.
Note que 3 íons cálcio [Ca2+] e 2 íons fosfato [PO43-] estão presentes em uma molécula eletricamente neutra de fosfato de cálcio [Ca3(PO4)2].
Valência do Cálcio (Ca) = 2 ; Valência do Phosphate (PO4) = 3.
Intercambiando suas valências e subscrevendo-as,
A fórmula do Fosfato de Cálcio é Ca3(PO4)2.
Note que 3 íons cálcio [Ca2+] e 2 íons fosfato [PO43-] estão presentes em uma molécula eletricamente neutra de fosfato de cálcio [Ca3(PO4)2].
Escreva
a fórmula química do Carbonato de Zinco.
Valência do Zinco (Zn) = 2 ; Valência do Carbonato (CO3) = 2.
Intercambiando suas valências e simplificando (dividindo por 2),
A fórmula do Carbonato de Zinco é ZnCO3.
Note que 1 íon zinco [Zn2+] e 1 íon carbonato [CO32-] estão presentes em uma molécula eletricamente neutra de carbonato de zinco [ZnCO3].
Valência do Zinco (Zn) = 2 ; Valência do Carbonato (CO3) = 2.
Intercambiando suas valências e simplificando (dividindo por 2),
A fórmula do Carbonato de Zinco é ZnCO3.
Note que 1 íon zinco [Zn2+] e 1 íon carbonato [CO32-] estão presentes em uma molécula eletricamente neutra de carbonato de zinco [ZnCO3].
Conclusão
Em suma
chega-se então a conclusão que O átomo foi definido como uma unidade
indivisível até o final do século XIX, quando foi proposto o primeiro modelo
atômico que provava a existência de partículas subatômicas. Com o passar dos
anos, novos estudos experimentais foram realizados e novos modelos atômicos
surgiram.
Baseado
no modelo atômico Rutherford-Bohr, o átomo é formado por uma região central
positiva denominada núcleo, cercado por elétrons em órbitas circulares. Os
átomos são formados basicamente por três partículas, são elas: prótons, nêutrons e elétrons
Bibliografia
FOGAçA, Jennifer Rocha Vargas.
"Estrutura do Átomo"; Brasil Escola. Disponível em <http://brasilescola.uol.com.br/quimica/estrutura-Atomo.htm>.
Acesso em 10 de fevereiro de 2016.
L'Annunziata, Michael F.. Handbook of Radioactivity Analysis.
[S.l.]: Academic Press, 2003.
Beyer, H. F.; Shevelko, V. P.. Introduction to the Physics of Highly
Charged Ions. [S.l.]: CRC Press, 2003.
Choppin, Gregory R.. Radiochemistry and Nuclear Chemistry.
[S.l.]: Elsevier, 2001. Close,
FE; Marten, Michael; Sutton, Christine. The Particle Odyssey: A Journey to the Heart of Matter.
[S.l.]: Oxford University Press, 2002.